行业资讯 首页 > 新闻动态 > 行业资讯
辉瑞新冠口服药在中国获批,可以终结新冠吗?
发布时间:2022-2-16 访问人数:1430

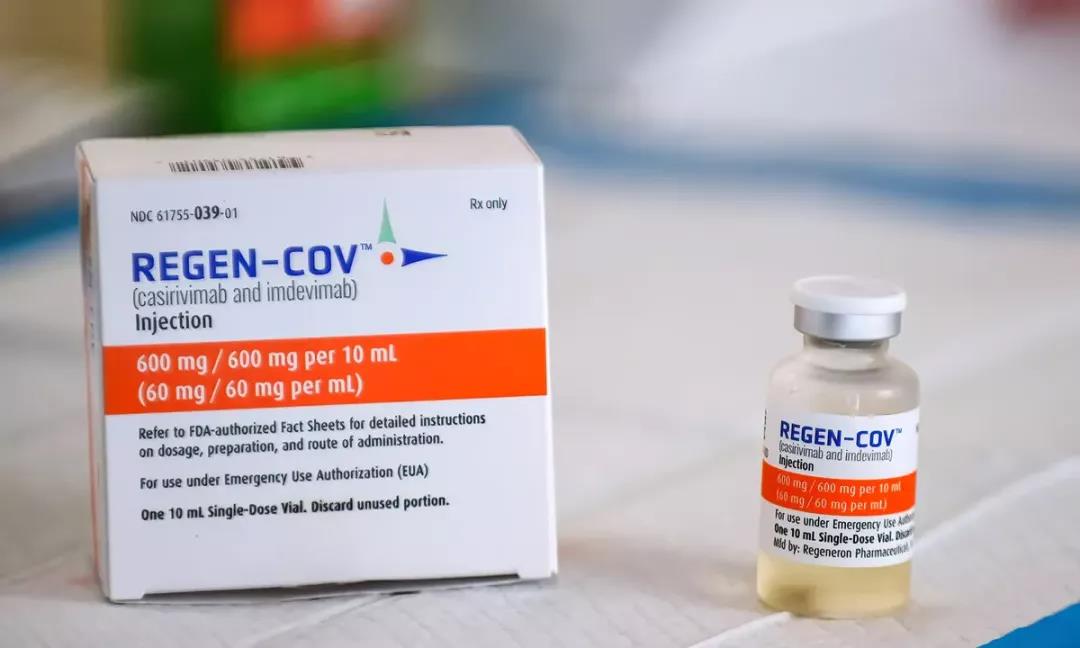

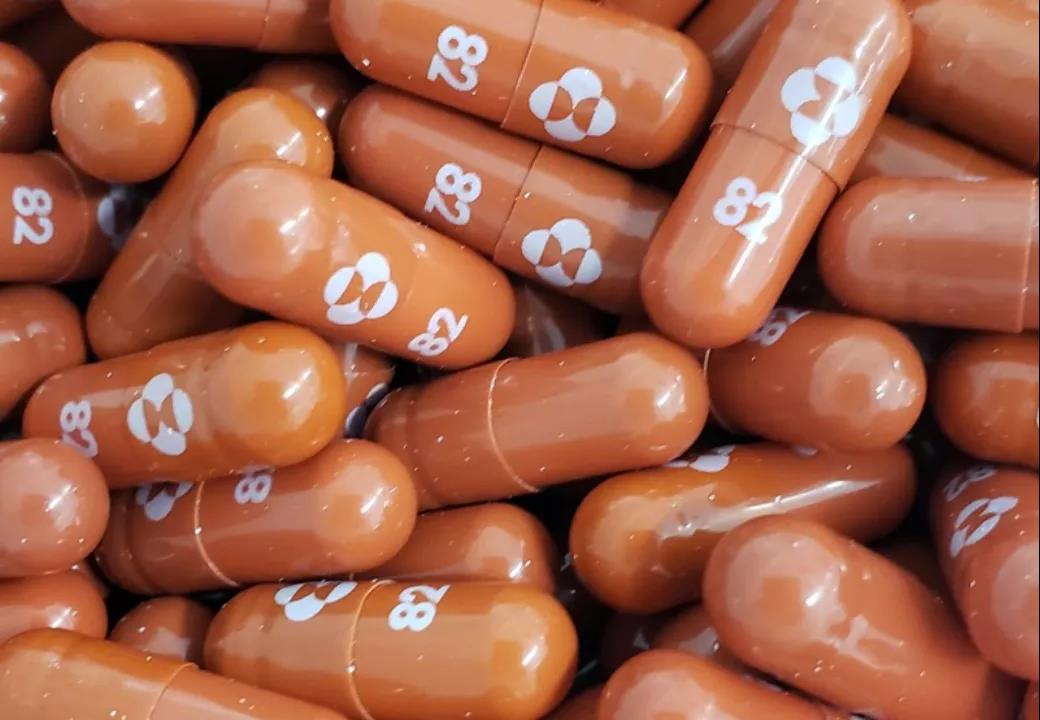
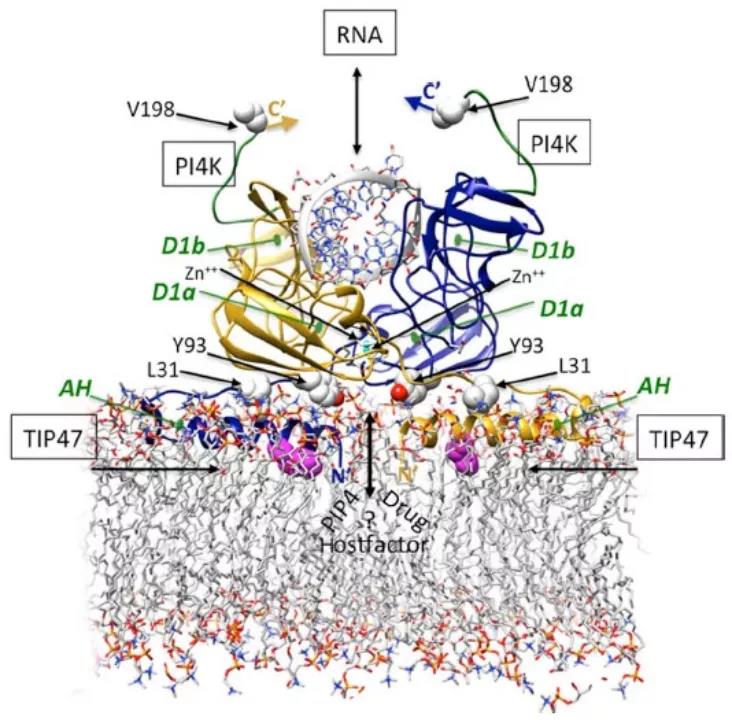
抗病毒药物的研发,往往需要借助现代分子库筛选,也就是通过将库内记载分子与靶点进行比对,从而发掘具有潜在活性的药物。
虽然这种方式能提高新药研发效率,但会导致药物和靶点的契合程度不足,从而可能会影响药效甚至诱导病毒产生耐药性。因此,药物设计过程中常需要对药物分子进行反复修改,甚至需要通过结构生物学等手段的配合,来设计出最匹配靶点的分子。






2006-2018 Copyright 南京探求生物技术有限公司